行業(yè)動態(tài)
您當(dāng)前的位置 > 行業(yè)動態(tài) > 行業(yè)法規(guī)
20個國內(nèi)特有品種,迎來評價(jià)辦法
加入日期:2019/6/25 12:00:19 查看人數(shù): 1025 作者:admin
重磅!20個國內(nèi)特有品種,迎來評價(jià)辦法,不重新開展臨床試驗(yàn),國家藥監(jiān)局將不建議使用。
剛剛,國家藥品監(jiān)督管理局藥品審評中心發(fā)布《國內(nèi)特有品種評價(jià)建議》的通知。

據(jù)通知,為落實(shí)原總局《關(guān)于仿制藥質(zhì)量和療效一致性評價(jià)工作有關(guān)事項(xiàng)的公告》(2017年第100號)的要求,仿制藥質(zhì)量與療效一致性評價(jià)辦公室組織人員對《關(guān)于落實(shí)<國務(wù)院辦公廳關(guān)于開展仿制藥質(zhì)量和療效一致性評價(jià)的意見>有關(guān)事項(xiàng)的公告》(2016年第106號)附件中的國內(nèi)特有品種進(jìn)行了梳理調(diào)研、專家論證和征求意見,明確了各品種的評價(jià)建議,現(xiàn)予發(fā)布。
企業(yè)應(yīng)當(dāng)承擔(dān)主體責(zé)任,根據(jù)原總局發(fā)布的《總局關(guān)于發(fā)布仿制藥質(zhì)量和療效一致性評價(jià)品種分類指導(dǎo)意見的通告》(2017年第49號),同時結(jié)合附件中的評價(jià)建議及相關(guān)技術(shù)指導(dǎo)原則,對國內(nèi)特有品種進(jìn)行深入研究。

根據(jù)原食藥監(jiān)總局2017年第49號文件的要求,針對國內(nèi)特有品種,由企業(yè)選擇可重新開展臨床試驗(yàn)證明其安全有效性,并參照《化學(xué)藥品仿制藥口服固體制劑質(zhì)量和療效一致性評價(jià)申報(bào)資料要求(試行)》提交申請,后續(xù)審核通過后視同通過一致性評價(jià)。
企業(yè)未選擇重新開展臨床試驗(yàn)的,國家食品藥品監(jiān)督管理總局對外公布其缺乏有效性數(shù)據(jù),不建議使用。
可以看到,一致性評價(jià)的進(jìn)程由易到難,已經(jīng)從口服劑型、注射劑型,再到國內(nèi)特有品種了。雖然這些國內(nèi)特有品種缺少參比制劑,但是仍然需要滿足相關(guān)指導(dǎo)原則研究和評價(jià)要求。
而這些藥品是否將呈現(xiàn)有效的數(shù)據(jù),也將決定他們后續(xù)的命運(yùn)。
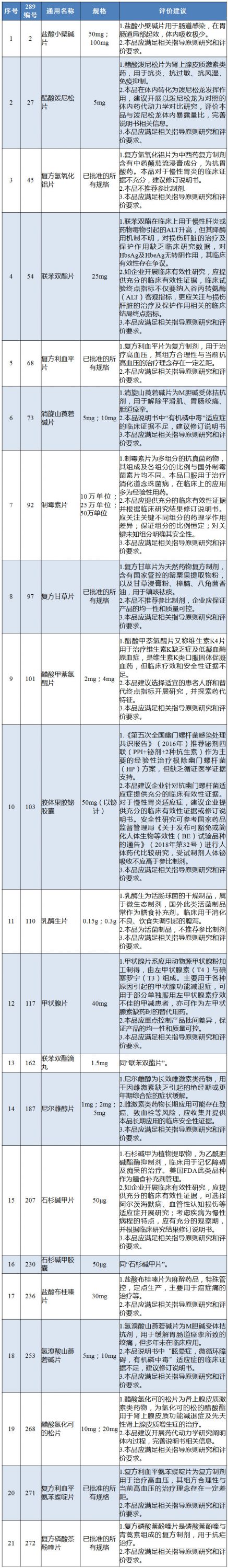
附:國內(nèi)特有品種評價(jià)建議