行業(yè)動(dòng)態(tài)
您當(dāng)前的位置 > 行業(yè)動(dòng)態(tài) > 行業(yè)法規(guī)
臨床急需境外新藥名單十大看點(diǎn)!
加入日期:2019/5/18 9:16:16 查看人數(shù): 1116 作者:admin
臨床急需境外新藥是指近十年在美國(guó)、歐盟或日本上市但未在我國(guó)境內(nèi)上市的用于治療罕見病的新藥,或用于防治嚴(yán)重危及生命疾病且尚無(wú)有效治療或預(yù)防手段的新藥,或用于防治嚴(yán)重危及生命疾病且具有明顯臨床優(yōu)勢(shì)的新藥。
2018年11月,CDE公布《臨床急需境外新藥名單(第一批)》,共40個(gè)產(chǎn)品進(jìn)入目錄。日前CDE發(fā)布第二批名單的征求意見稿,涉及30個(gè)產(chǎn)品。
臨床急需境外新藥將加快急需用藥上市。那么,哪些疾病、哪些藥物可以布局呢?近六成為罕見病用藥,是否意味著罕見病藥物的黃金時(shí)代已經(jīng)到來(lái)?
筆者對(duì)兩批名單的70個(gè)產(chǎn)品進(jìn)行細(xì)致分析,總結(jié)和點(diǎn)評(píng)出10個(gè)看點(diǎn)。
看點(diǎn) 1
罕見病用藥
結(jié)合第一批和第二批數(shù)據(jù),罕見病依然是列為臨床急需的主要原因,70個(gè)產(chǎn)品中有40個(gè)屬于罕見病藥/孤兒藥。29個(gè)屬于防治嚴(yán)重危及生命疾病且具有明顯臨床優(yōu)勢(shì)的新藥。僅1個(gè)新藥重組帶狀皰疹疫苗為用于防治嚴(yán)重危及生命疾病且尚未有效治療或預(yù)防手段的新藥,也是唯一一個(gè)進(jìn)入名單的疫苗。
臨床急需境外新藥將加快急需用藥上市。然而第一批名單目錄公布之后,仍有17個(gè)產(chǎn)品尚未啟動(dòng)申報(bào),82%都是罕見病用藥。仿制藥“4+7”帶量采購(gòu)啟動(dòng)之后,已有企業(yè)開始布局罕見病,例如上文所述多發(fā)性硬化癥、營(yíng)養(yǎng)性角膜炎等疾病國(guó)內(nèi)已有企業(yè)開始布局。然而,在醫(yī)保政策和渠道可及性等問(wèn)題尚未明晰的情況下,許多企業(yè)認(rèn)為罕見病藥品黃金時(shí)代仍未正式開啟。
看點(diǎn) 2
美國(guó)企業(yè)產(chǎn)品
從首次上市的國(guó)家來(lái)看,美國(guó)占據(jù)最大的比例,70個(gè)產(chǎn)品中共46個(gè)產(chǎn)品首先在美國(guó)上市。其次是歐盟17個(gè),日本7個(gè)。
生產(chǎn)企業(yè)方面,強(qiáng)生最多產(chǎn)品(5個(gè))入選目錄,包括阿帕魯胺片(apalutamide)、烏司奴單抗注射液(ustekinumab)、司妥昔單抗(Siltuximab)、Guselkumab和波生坦分散片(Tracleer 32mg dispersible tablets)。其次是諾華(4個(gè)),包括司庫(kù)奇尤單抗注射液(Secukinumab)、芬戈莫德鹽酸口服膠囊(Fingolimod HCl Oral Capsules)、卡那奴單抗(Canakinumab)和索尼吉布(Sonidegib)。健贊、吉利德和輝瑞都各有3個(gè)產(chǎn)品進(jìn)入目錄。
看點(diǎn) 3
熱門適應(yīng)癥
兩批目錄藥品涉及感染性疾病、免疫系統(tǒng)疾病、內(nèi)分泌和代謝病、皮膚疾病、神經(jīng)系統(tǒng)、心腦血管疾病和腫瘤等治療領(lǐng)域。從適應(yīng)癥來(lái)看,丙肝、多發(fā)性硬化癥、法布雷病、肺動(dòng)脈高壓、戈謝病、遺傳性血管性水腫和銀屑病都是對(duì)應(yīng)產(chǎn)品超過(guò)3個(gè)的適應(yīng)癥。值得注意的是,貝前列素鈉(Beraprost sodium)和西地那非(Sildenafil Citrate)早已在國(guó)內(nèi)上市,預(yù)計(jì)本次納入第二批目錄是因?yàn)樾枰黾舆m應(yīng)癥。

看點(diǎn) 4
兒童用藥
兒童用藥是近年來(lái)醫(yī)保、基藥政策扶持傾向的產(chǎn)品,第一批目錄共入選5個(gè)兒童用藥,分別為冷吡啉相關(guān)的周期性綜合征的卡那奴單抗(Canakinumab)和列洛西普(Rilonacept),治療兒童和成人Ⅶ型黏多糖貯積癥的Vestronidase Alfa-Vjbk,治療神經(jīng)母細(xì)胞瘤的達(dá)妥昔單抗(Dinutuximab)和達(dá)妥昔單抗β(Dinutuximab Beta)。都是生物制品,以單抗類產(chǎn)品為主。
第二批目錄新增了5個(gè)兒童用藥,分別是治療兒童嚴(yán)重原發(fā)性胰島素樣因子1缺乏、生長(zhǎng)激素受體基因缺陷、體內(nèi)出現(xiàn)生長(zhǎng)激素中和和抗體導(dǎo)致的生長(zhǎng)不足的患兒的美卡舍明注射劑(Mecasermin [rDNA origin])Injection),治療1個(gè)月到2歲嬰兒的嬰兒痙攣癥(IS)、與其他療法一起用于治療10歲及以上成年人和兒童的頑固性復(fù)合部分發(fā)作性癲癇(CPS)的氨己烯酸片(vigabatrin),治療4歲以上兒童及青少年嚴(yán)重性春季角膜結(jié)膜炎(VKC)的環(huán)孢素滴眼液(ciclosporin),治療X連鎖低磷佝僂病的Crysvita(Burosumab),治療肺動(dòng)脈高壓的波生坦分散片(Tracleer 32mg dispersible tablets)。波生坦片已在國(guó)內(nèi)上市,波生坦分散片由于兒童劑型而進(jìn)入第二批目錄。
看點(diǎn) 5
靶點(diǎn)
靶點(diǎn)方面,除了環(huán)孢素滴眼液(ciclosporin)和環(huán)硅酸鋯鈉口服干混懸液(sodium zirconium cyclosilicate)沒(méi)有公布靶點(diǎn)以外,目前每個(gè)靶點(diǎn)最多2個(gè)產(chǎn)品進(jìn)入目錄。
看點(diǎn) 6
單抗
單抗類藥品是進(jìn)入臨床急需境外新藥最大的一個(gè)類別,共有17個(gè)單抗進(jìn)入兩批目錄,對(duì)應(yīng)的適應(yīng)癥主要是抗腫瘤和免疫系統(tǒng)用藥。其中第二批目錄的阿達(dá)木單抗已在國(guó)內(nèi)已經(jīng)上市,預(yù)計(jì)進(jìn)入目錄也是為了增加適應(yīng)癥。
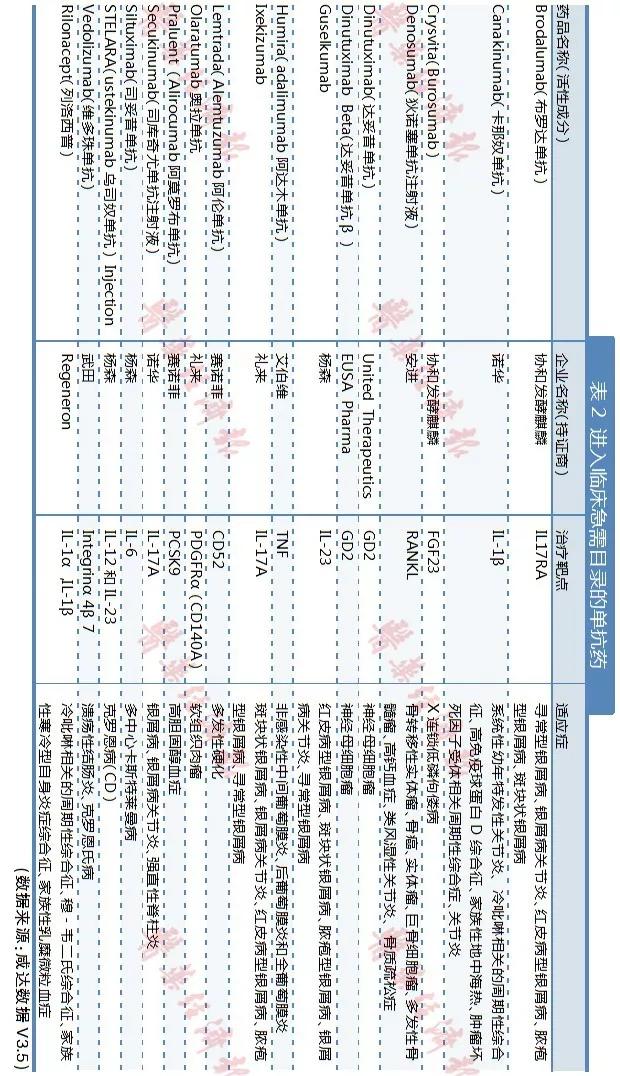
看點(diǎn) 7
目錄發(fā)布后上市產(chǎn)品
第一批目錄40個(gè)產(chǎn)品公布后,共有4個(gè)產(chǎn)品獲批上市,分別是諾華的司庫(kù)奇尤單抗注射液(Secukinumab)、吉利德的來(lái)迪派韋索磷布韋片(Ledipasvir And Sofosbuvir)、百健的諾西那生鈉(Nusinersen)和Actelion的司來(lái)帕格(Selexipag)。其中,僅來(lái)迪派韋索磷布韋片啟動(dòng)了臨床試驗(yàn)。
看點(diǎn) 8
納入5.1類產(chǎn)品
第二批目錄中,有國(guó)內(nèi)已上市仿制藥但國(guó)外該活性成分獲批罕見病適應(yīng)癥的原研產(chǎn)品。例如依達(dá)拉奉氯化鈉注射液(Radicava,田邊三菱制藥)用于延緩肌萎縮側(cè)索硬化(ALS)患者的神經(jīng)功能下降已在美日上市,該產(chǎn)品2019年以“5.1類”申報(bào)生產(chǎn)。
看點(diǎn) 9
神經(jīng)生長(zhǎng)因子類產(chǎn)品
神經(jīng)生長(zhǎng)因子類產(chǎn)品最近在國(guó)內(nèi)被卷入“輔助用藥”目錄,因此有必要關(guān)注被納入第一批名單的重組人神經(jīng)生長(zhǎng)因子滴眼液Cenegermin。
Cenegermin在歐盟和美國(guó)獲準(zhǔn)用于中度至重度神經(jīng)營(yíng)養(yǎng)性角膜炎(neurotrophic keratitis,NK)。神經(jīng)營(yíng)養(yǎng)性角膜炎是角膜上皮愈合障礙的一種變性疾病,其特征是角膜感覺(jué)缺失,形成大面積的角膜上皮缺失和潰瘍,潰瘍進(jìn)展嚴(yán)重的可造成角膜穿孔。神經(jīng)營(yíng)養(yǎng)性角膜炎患者數(shù)量少,是一種眼科罕見病,目前人群發(fā)病率約為萬(wàn)分之五。重組人神經(jīng)生長(zhǎng)因子滴眼液可幫助恢復(fù)眼部的正常愈合過(guò)程,并修復(fù)角膜的損傷。
看點(diǎn) 10
市場(chǎng)潛力最大的產(chǎn)品
預(yù)計(jì)市場(chǎng)潛力最大的產(chǎn)品為流感用藥鹽野義制藥的博洛昔韋片(Baloxavir marboxil)和第一三共制藥的拉尼米韋辛酸酯水合物干粉吸入劑(laninamivir octanoate hydrate)。
目前國(guó)內(nèi)的抗流感藥奧司他韋一家獨(dú)大,而博洛昔韋片(Baloxavir marboxil)已經(jīng)批準(zhǔn)臨床。鑒于這兩個(gè)產(chǎn)品都屬于日本已上市的產(chǎn)品,進(jìn)入臨床急需名單的新藥若是已在日本或中國(guó)香港、澳門和臺(tái)灣地區(qū)上市且有充分臨床使用病例的藥品,申請(qǐng)人提供上述國(guó)家及地區(qū)藥品使用情況研究報(bào)告并進(jìn)行相關(guān)分析,可暫不提供人種差異研究資料,有望加快獲批上市。