行業(yè)動(dòng)態(tài)
您當(dāng)前的位置 > 行業(yè)動(dòng)態(tài) > 行業(yè)法規(guī)
PD-1市場(chǎng)再迎強(qiáng)者 價(jià)格戰(zhàn)悄然開(kāi)打
加入日期:2019/6/6 11:06:00 查看人數(shù): 1120 作者:admin
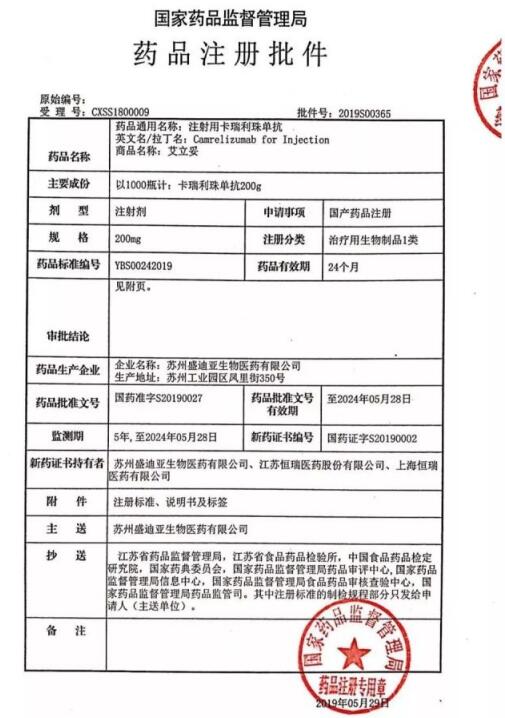
本就火熱的PD-1市場(chǎng)再迎強(qiáng)勢(shì)入局者。5月31日,恒瑞醫(yī)藥注射用卡瑞利珠單抗獲批,適用于至少經(jīng)過(guò)二線系統(tǒng)化療的復(fù)發(fā)或難治性經(jīng)典型霍奇金淋巴瘤患者的治療。至此,國(guó)內(nèi)PD-1市場(chǎng)已經(jīng)囊括百時(shí)美施貴寶(BMS)、默沙東、信達(dá)生物、君實(shí)生物等數(shù)家企業(yè),百濟(jì)神州等企業(yè)的相關(guān)藥品也正處于上市申請(qǐng)審批階段。
北京鼎臣醫(yī)藥管理咨詢中心創(chuàng)始人史立臣認(rèn)為,由于獲批適應(yīng)證的不同,短期內(nèi)PD-1進(jìn)入價(jià)格競(jìng)爭(zhēng)的幾率不大,更廣泛適應(yīng)證獲批的競(jìng)爭(zhēng)是當(dāng)前的重點(diǎn),但PD-1對(duì)企業(yè)的研發(fā)實(shí)力有較高要求,“投入成本很大,實(shí)力不強(qiáng)的企業(yè)如果進(jìn)入,結(jié)果不會(huì)太好?!?
恒瑞入局PD-1市場(chǎng)
恒瑞醫(yī)藥獲批的注射用卡瑞利珠單抗是人源化抗PD-1單克隆抗體,可與人PD-1受體結(jié)合并阻斷PD-1/PD-L1通路,恢復(fù)機(jī)體的抗腫瘤免疫力,從而形成癌癥免疫治療基礎(chǔ)。
通常來(lái)說(shuō),T細(xì)胞能夠殺死癌細(xì)胞,久而久之,癌細(xì)胞開(kāi)始“自救”,即在表面產(chǎn)生一種特殊的蛋白質(zhì),與T細(xì)胞結(jié)合,令T細(xì)胞產(chǎn)生“錯(cuò)覺(jué)”,認(rèn)為癌細(xì)胞“無(wú)害”,同時(shí)使得T細(xì)胞的活性降低,這種特殊的蛋白質(zhì)就是PD-L1。癌細(xì)胞表面的PD-L1和T細(xì)胞表面的PD-1結(jié)合,會(huì)誘導(dǎo)T細(xì)胞凋亡瓦解、抑制T細(xì)胞的增殖。PD-1抑制劑和PD-L1抑制劑,通過(guò)阻斷PD-1和PD-L1的結(jié)合,使T細(xì)胞能夠正確的識(shí)別癌細(xì)胞,實(shí)現(xiàn)殺滅癌細(xì)胞的目的。因與傳統(tǒng)癌癥治療的放化療方法不同,PD-1作用于人體免疫系統(tǒng),也被認(rèn)為是抗腫瘤治療的“撒手锏”。
在恒瑞入局后,國(guó)內(nèi)相關(guān)企業(yè)已經(jīng)達(dá)到5家。其中,外資企業(yè)百時(shí)美施貴寶PD-1抗體藥物歐狄沃(簡(jiǎn)稱O藥)與默沙東PD-1抗體藥物可瑞達(dá)(簡(jiǎn)稱K藥)均已進(jìn)入內(nèi)地市場(chǎng)。2018年12月,首個(gè)國(guó)產(chǎn)PD-1單抗拓益獲批上市,2019年2月,信達(dá)生物PD-1信迪利單抗注射液正式上市。
前不久,“O藥”不良反應(yīng)事件給當(dāng)下正熱的PD-1市場(chǎng)潑了一盆冷水?!癘藥”在日本上市4年內(nèi),有11例垂體功能障礙與Opdivo存在因果關(guān)系,包括3例黑色素瘤和8例非小細(xì)胞肺癌患者,2018年11月7日,更有一例非小細(xì)胞肺癌死亡病例。百時(shí)美施貴寶隨后發(fā)布聲明稱,截至目前,在中國(guó)衛(wèi)生監(jiān)管部門所批準(zhǔn)的適應(yīng)證范圍內(nèi),未獲悉類似潛在不良事件。與此同時(shí),作為罕見(jiàn)不良反應(yīng),腦垂體炎已在全球及中國(guó)獲批適應(yīng)證產(chǎn)品說(shuō)明書中標(biāo)明,用以提醒醫(yī)療專業(yè)人士發(fā)現(xiàn)并及時(shí)采取相應(yīng)措施。日本厚生勞動(dòng)省要求小野藥品工業(yè)在其生產(chǎn)的抗癌藥Opdivo的使用說(shuō)明中增補(bǔ)“重大副作用”內(nèi)容。
價(jià)格戰(zhàn)悄然開(kāi)打
PD-1被認(rèn)為是抗腫瘤治療的“撒手锏”,其市場(chǎng)規(guī)模也不容小覷。
IMS數(shù)據(jù)庫(kù)顯示,2017年P(guān)D-1抗體全球銷售額約為88.3億美元。到了2018年,這一數(shù)字已經(jīng)達(dá)141.78億美元,國(guó)內(nèi)銷售額約為643.75萬(wàn)美元。6月3日,東吳證券發(fā)布研報(bào)稱,預(yù)計(jì)國(guó)內(nèi)PD-1市場(chǎng)空間將超過(guò)700億元。龐大的市場(chǎng)份額面前,各大藥企紛紛進(jìn)軍PD-1市場(chǎng),爭(zhēng)奪也從未停止。除了已經(jīng)在國(guó)內(nèi)獲批的5家企業(yè),百濟(jì)神州等企業(yè)的相關(guān)藥品正處于上市申請(qǐng)審批階段。
不僅如此,已經(jīng)獲批上市的企業(yè),已經(jīng)打起了價(jià)格戰(zhàn)。
2019年1月7日,首個(gè)國(guó)產(chǎn)PD-1君實(shí)生物的拓益公布了7200元/240mg(支)的定價(jià),合30元/mg,拓益適應(yīng)證為黑色素瘤,患者年治療費(fèi)用18.72萬(wàn)元,再加上藥物援助方案,符合贈(zèng)藥條件的患者一年治療費(fèi)用預(yù)估在10萬(wàn)以下。兩個(gè)月之后的3月5日,信達(dá)公布,信迪利中國(guó)地區(qū)的售價(jià)為7838元/100mg,是“K”藥(帕博利珠單抗)同等規(guī)格的四折左右,亦低于同規(guī)格的“O”藥價(jià)格。信達(dá)還同時(shí)推出“3+2”積分項(xiàng)目,援助后,患者每個(gè)月的治療費(fèi)用約為1.39萬(wàn),年治療費(fèi)用為16.7萬(wàn)左右。
不僅如此,“O”藥和“K”藥在國(guó)內(nèi)的價(jià)格也幾乎是全球最低水平。K藥(黑色素瘤適應(yīng)證)價(jià)格為17918元/100mg(支),合179元/mg,患者年費(fèi)用大約在60萬(wàn)元。O藥價(jià)格為40mg/10ml:4591元;100mg/10ml:9260元。不同病情和體重的患者劑量和用藥不一樣,患者年均費(fèi)用在30萬(wàn)左右。
在北京鼎臣醫(yī)藥管理咨詢中心創(chuàng)始人史立臣看來(lái),由于獲批適應(yīng)證的不同,短期內(nèi)PD-1價(jià)格競(jìng)爭(zhēng)仍有限,從長(zhǎng)遠(yuǎn)來(lái)看,“三五年之后,隨著各PD-1在獲批適應(yīng)證上有一定的重合性,進(jìn)入真正的價(jià)格競(jìng)爭(zhēng)階段是有可能的。”
PD-1市場(chǎng)的“準(zhǔn)”競(jìng)爭(zhēng)者并不少。2018年8月百濟(jì)神州提交了PD-1單抗的申請(qǐng),獲批只是時(shí)間問(wèn)題,第二梯隊(duì)方面包括正大天晴、復(fù)宏漢霖、海正藥業(yè)等十余家企業(yè),亦有涉及30余款PD-1/PD-L1單抗在研。
適應(yīng)證之爭(zhēng)將繼續(xù)
業(yè)界普遍認(rèn)為,更廣泛適應(yīng)證的獲批,已經(jīng)成為PD-1市場(chǎng)的競(jìng)爭(zhēng)重點(diǎn)。
在已經(jīng)獲批的產(chǎn)品方面,默沙東先人一步。2019年3月29日,“K”藥獲批了新的適應(yīng)證:聯(lián)合培美曲塞、順鉑一線治療EGFR和ALK陰性的轉(zhuǎn)移性非鱗狀非小細(xì)胞肺癌(NSCLC)。
除君實(shí)獲批適應(yīng)證為黑色素瘤外,信達(dá)、恒瑞和百濟(jì)申請(qǐng)的均為霍奇金淋巴瘤。
從國(guó)內(nèi)上市產(chǎn)品在國(guó)外獲批的適應(yīng)證不難看出,適應(yīng)證之爭(zhēng)還將繼續(xù)。以國(guó)內(nèi)最早上市的歐狄沃為例,該藥已在全球超過(guò)65個(gè)國(guó)家及地區(qū)獲得批準(zhǔn),在美國(guó),歐狄沃已獲批15項(xiàng)適應(yīng)證,涉及非小細(xì)胞肺癌、黑色素瘤、腎癌、霍奇金淋巴瘤等8個(gè)瘤種,在日本、韓國(guó)和中國(guó)臺(tái)灣,歐狄沃胃癌適應(yīng)證也已獲得批準(zhǔn)。
國(guó)內(nèi)企業(yè)方面,以百濟(jì)神州為例,雖然產(chǎn)品尚未正式獲批,但在適應(yīng)證領(lǐng)域的爭(zhēng)奪已經(jīng)展開(kāi)。百濟(jì)神州高級(jí)副總裁汪來(lái)在接受新京報(bào)記者采訪時(shí)就表示,目前百濟(jì)神州已經(jīng)在進(jìn)行的PD-1注冊(cè)性臨床試驗(yàn)有14項(xiàng),覆蓋不同的適應(yīng)證,其中有7項(xiàng)是全球注冊(cè)性臨床試驗(yàn)?!俺艘酝?,我們今年還會(huì)展開(kāi)多項(xiàng)PD-1的注冊(cè)性試驗(yàn),所以到今年年底,PD-1注冊(cè)性臨床試驗(yàn)預(yù)計(jì)會(huì)超過(guò)14項(xiàng)?!蓖魜?lái)表示,百濟(jì)神州在定價(jià)時(shí)也會(huì)充分考慮患者的需求和可負(fù)擔(dān)性。
史立臣表示,“PD-1市場(chǎng)的競(jìng)爭(zhēng)已經(jīng)成為更廣泛適應(yīng)證獲批的競(jìng)爭(zhēng),要增加適用人群,必然依靠適應(yīng)證范圍的擴(kuò)大,但這種擴(kuò)大是有速度的。”
另一方面,對(duì)研發(fā)實(shí)力要求頗高的PD-1領(lǐng)域,對(duì)部分企業(yè)來(lái)說(shuō)并不友好,單就數(shù)字而言,恒瑞醫(yī)藥在獲批產(chǎn)品項(xiàng)目中已投入研發(fā)費(fèi)用約為5.04億元。史立臣指出,“按照目前的審批速度,到明年下半年應(yīng)該會(huì)有幾個(gè)產(chǎn)品獲批上市。投入成本很大,實(shí)力不強(qiáng)的企業(yè)如果貿(mào)然進(jìn)入,結(jié)果不會(huì)太好。因?yàn)樵兴幰呀?jīng)進(jìn)來(lái)了,國(guó)內(nèi)企業(yè)也在摩拳擦掌?!?